H2SO4 là gì và ứng dụng trong đời sống và công nghiệp?
Giới thiệu
H2SO4 (axit sulfuric) là một trong những hóa chất quan trọng nhất và được sử dụng rộng rãi nhất trong cả công nghiệp và đời sống. Được biết đến như một chất có tính ăn mòn cao, H2SO4 là một axit vô cơ mạnh, không màu, dễ tan trong nước và có vai trò quan trọng trong nhiều quy trình sản xuất, từ công nghiệp hóa chất, sản xuất phân bón, đến xử lý kim loại. Với khả năng tương tác hóa học đa dạng và sức mạnh tẩy rửa vượt trội, axit sulfuric không chỉ là một hợp chất hóa học mà còn là nền tảng cho nhiều ngành công nghiệp hiện đại.
1. H2SO4 là gì?
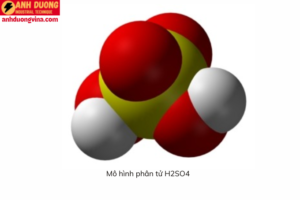
H2SO4, còn được gọi là axit sulfuric, là một hợp chất hóa học có công thức phân tử gồm hai nguyên tử hydro (H), một nguyên tử lưu huỳnh (S), và bốn nguyên tử oxy (O). Trong trạng thái tinh khiết, axit sulfuric là một chất lỏng không màu, có khả năng hút nước mạnh, và là một trong những chất có tính ăn mòn cao nhất. Đây là một axit mạnh, có thể hòa tan trong nước ở bất kỳ tỷ lệ nào, và khi pha loãng, nó vẫn giữ nguyên tính chất hóa học đặc trưng.

Một trong những đặc điểm nổi bật của H2SO4 là tính hút nước mạnh (hygroscopic), nghĩa là nó có khả năng hấp thụ hơi nước từ môi trường xung quanh. Chính tính chất này khiến H2SO4 trở thành một chất tẩy rửa và chất làm khô trong nhiều ứng dụng công nghiệp.
2. Đặc điểm và tính chất của H2SO4
H2SO4 có một số đặc điểm và tính chất hóa học nổi bật như sau:
- Tính ăn mòn cao: Axit sulfuric là một axit cực kỳ mạnh, có khả năng ăn mòn nhiều kim loại và hợp chất hữu cơ.
- Dễ tan trong nước: H2SO4 có khả năng hòa tan tốt trong nước. Tuy nhiên, khi pha loãng H2SO4, cần chú ý cho axit vào nước từ từ để tránh phản ứng tỏa nhiệt mạnh, có thể gây nguy hiểm.
- Tính háo nước: Axit sulfuric dễ dàng hút ẩm từ không khí, khiến nó trở thành một chất hút ẩm mạnh.
- Phản ứng hóa học mạnh mẽ: H2SO4 dễ dàng phản ứng với nhiều kim loại, chất hữu cơ và chất vô cơ khác, giải phóng khí hydrogen hoặc tạo ra các sản phẩm mới.
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb) tạo thành muối sunfat.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo tạo thành muối mới (trong đó kim loại giữ nguyên hóa trị) và nước .
FeO + H2SO4 → FeSO4 + H2O
- Axit sunfuric tác dụng với bazo tạo thành muối mới và nước.
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 tác dụng với muối tạo thành muối mới (trong đó kim loại vẫn giữ nguyên hóa trị) và axit mới.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
3. Quá trình sản xuất H2SO4
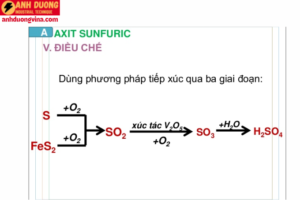
Axit sulfuric được sản xuất chủ yếu bằng quy trình tiếp xúc (Contact Process). Quy trình này bao gồm các bước chính:
- Sản xuất SO2 (lưu huỳnh dioxit): Lưu huỳnh (S) được đốt trong không khí để tạo ra SO2.
- Oxy hóa SO2 thành SO3: SO2 sau đó được oxy hóa thêm một lần nữa trong điều kiện có mặt xúc tác (thường là vanadi pentoxit) để tạo thành SO3 (lưu huỳnh trioxit).
- Hòa tan SO3 vào H2SO4: Cuối cùng, SO3 được hấp thụ vào H2SO4 để tạo ra oleum (H2SO4 giàu SO3), sau đó pha loãng để tạo ra H2SO4 thương mại.
4. Ứng dụng của H2SO4

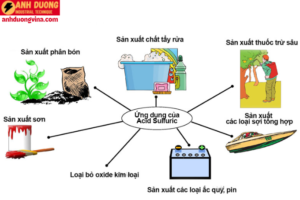
H2SO4 có vô số ứng dụng trong đời sống và công nghiệp, từ những quy trình hóa học phức tạp đến các hoạt động hàng ngày. Dưới đây là một số ứng dụng chính:
4.1 Sản xuất phân bón
Khoảng 60% lượng H2SO4 được sử dụng để sản xuất phân bón, chủ yếu là phân superphosphate và ammonium sulfate. Axit sulfuric được sử dụng để xử lý các khoáng chất chứa photphat, tạo ra phân bón giàu dinh dưỡng, giúp cây trồng phát triển mạnh mẽ và năng suất cao.
4.2 Xử lý kim loại và làm sạch bề mặt
H2SO4 thường được sử dụng trong quá trình tẩy rửa bề mặt kim loại, loại bỏ gỉ sét và oxit trên các sản phẩm kim loại như thép trước khi chúng được phủ hoặc sơn. Axit này giúp làm sạch bề mặt kim loại, tạo điều kiện tốt nhất cho các quá trình xử lý tiếp theo như mạ điện hoặc sơn phủ.
4.3 Sản xuất hóa chất
Axit sulfuric là nguyên liệu cơ bản trong sản xuất nhiều hợp chất hóa học khác, chẳng hạn như axit nitric (HNO3), axit clohidric (HCl) và nhiều hợp chất khác. Nó cũng là nguyên liệu chính trong sản xuất chất tẩy rửa, chất dẻo và các sản phẩm hóa học tiêu dùng.
4.4 Sản xuất pin ắc quy
H2SO4 được sử dụng trong pin ắc quy chì – loại pin được sử dụng phổ biến trong xe hơi và các thiết bị lưu trữ năng lượng. Axit sulfuric đóng vai trò là chất điện giải, giúp tạo ra dòng điện trong quá trình sạc và xả của pin.
4.5 Xử lý nước thải
Trong ngành công nghiệp xử lý nước, H2SO4 được sử dụng để điều chỉnh độ pH của nước thải trước khi xả ra môi trường. Việc điều chỉnh độ pH bằng axit sulfuric giúp loại bỏ các chất gây ô nhiễm trong nước thải, đảm bảo nước thải ra môi trường an toàn và không gây hại cho hệ sinh thái.
4.6 Sản xuất chất dẻo và sợi tổng hợp
H2SO4 cũng được sử dụng trong ngành sản xuất chất dẻo và sợi tổng hợp như nylon, polyester, và các loại vật liệu dệt khác. Axit sulfuric giúp xúc tác các phản ứng hóa học trong quá trình sản xuất, đảm bảo sản phẩm có chất lượng cao và độ bền tốt.
5. Lưu ý an toàn khi sử dụng H2SO4
Vì H2SO4 là một chất có tính ăn mòn cực mạnh, việc sử dụng và bảo quản axit này cần tuân thủ nghiêm ngặt các quy tắc an toàn:
- Sử dụng đồ bảo hộ: Khi làm việc với H2SO4, cần mặc đầy đủ đồ bảo hộ như găng tay, kính bảo hộ, áo khoác bảo hộ và khẩu trang để tránh tiếp xúc trực tiếp với axit.
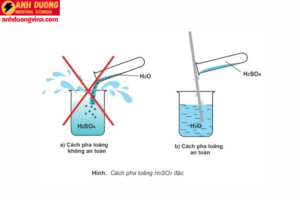
- Pha loãng đúng cách: Khi cần pha loãng H2SO4, luôn cho axit vào nước chứ không phải ngược lại để tránh phản ứng tỏa nhiệt mạnh, có thể gây bỏng.
- Lưu trữ an toàn: Axit sulfuric nên được lưu trữ trong các thùng chứa bằng nhựa chịu axit hoặc kim loại đặc biệt. Đảm bảo lưu trữ ở nơi thoáng mát, tránh ánh nắng trực tiếp và xa tầm tay trẻ em.
6. Kết luận
H2SO4 (axit sulfuric) là một hóa chất cực kỳ quan trọng và có ứng dụng rộng rãi trong nhiều ngành công nghiệp từ sản xuất phân bón, hóa chất, đến xử lý kim loại và sản xuất pin. Tuy nhiên, do tính ăn mòn mạnh, việc sử dụng H2SO4 cần phải tuân thủ nghiêm ngặt các quy định về an toàn để đảm bảo bảo vệ con người và môi trường. Với vai trò không thể thiếu trong nền công nghiệp hiện đại, H2SO4 tiếp tục là một hợp chất quan trọng góp phần thúc đẩy sản xuất và cải tiến công nghệ.


