Internet of Thing, Vật Liệu
Cách tạo ra axit H₂SO₄: Quy trình sản xuất và ứng dụng
Cách tạo ra axit H₂SO₄: Quy trình sản xuất và ứng dụng
Giới thiệu
Axit sulfuric (H₂SO₄) là một trong những hóa chất quan trọng nhất trong công nghiệp hiện đại, được sử dụng rộng rãi trong sản xuất phân bón, hóa chất, xử lý kim loại và nhiều lĩnh vực khác. Axit H₂SO₄ được sản xuất chủ yếu bằng hai phương pháp chính: phương pháp tiếp xúc (Contact Process) và phương pháp buồng chì (Lead Chamber Process). Trong đó, phương pháp tiếp xúc là phương pháp phổ biến và hiện đại nhất hiện nay, nhờ vào khả năng sản xuất axit với độ tinh khiết cao và hiệu suất tốt.

1. Phương pháp sản xuất axit H₂SO₄ bằng quy trình tiếp xúc (Contact Process)
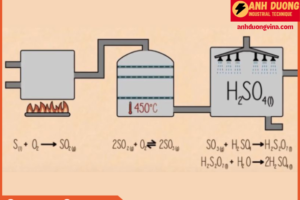
Phương pháp tiếp xúc là quy trình sản xuất axit sulfuric phổ biến nhất hiện nay. Quy trình này bao gồm ba bước chính:
Bước 1: Đốt lưu huỳnh để tạo khí SO₂
- Nguyên liệu: Lưu huỳnh (S) hoặc quặng pyrit (FeS₂).
- Phản ứng hóa học: S+O2→SO2S + O₂ → SO₂ Lưu huỳnh hoặc pyrit được đốt cháy trong không khí để tạo thành lưu huỳnh dioxit (SO₂).
Bước 2: Oxy hóa SO₂ thành SO₃
- Quá trình oxy hóa: SO₂ được chuyển hóa thành lưu huỳnh trioxit (SO₃) qua một phản ứng oxy hóa xúc tác, thường sử dụng vanadi pentoxit (V₂O₅) làm xúc tác ở nhiệt độ khoảng 450°C.2SO2+O2⟶V2O52SO32SO₂ + O₂ \overset{V₂O₅}{\longrightarrow} 2SO₃Đây là bước quan trọng trong quy trình sản xuất, với việc SO₂ phản ứng với oxy trong không khí để tạo thành SO₃.
Bước 3: Hấp thụ SO₃ vào axit sulfuric
- Hấp thụ SO₃: Lưu huỳnh trioxit (SO₃) sau đó được hấp thụ vào axit sulfuric (H₂SO₄) đậm đặc để tạo ra oleum (H₂SO₄·SO₃).SO3+H2SO4→H2S2O7 (oleum)SO₃ + H₂SO₄ → H₂S₂O₇ \, (\text{oleum})
- Pha loãng oleum: Oleum sau đó được pha loãng với nước để tạo ra axit sulfuric có nồng độ mong muốn.H2S2O7+H2O→2H2SO4H₂S₂O₇ + H₂O → 2H₂SO₄
Phương pháp tiếp xúc tạo ra axit sulfuric có độ tinh khiết và nồng độ cao, thường đạt từ 98% đến 99%.
2. Phương pháp buồng chì (Lead Chamber Process)

Phương pháp buồng chì là quy trình sản xuất axit sulfuric lâu đời hơn, hiện ít được sử dụng do hiệu suất thấp hơn và axit sản xuất ra có nồng độ thấp hơn so với phương pháp tiếp xúc.
- Quá trình phản ứng: Lưu huỳnh dioxit (SO₂) được tạo ra bằng cách đốt lưu huỳnh hoặc quặng pyrit, sau đó được dẫn qua các buồng chứa đầy hơi nước và oxit nitơ (NOₓ). SO₂ trong môi trường này phản ứng với NOₓ để tạo ra axit sulfuric loãng.
Phương pháp này sản xuất axit sulfuric loãng (khoảng 65-78%) và ít hiệu quả hơn so với phương pháp tiếp xúc.
3. Ứng dụng của axit H₂SO₄

Axit sulfuric có nhiều ứng dụng quan trọng trong đời sống và công nghiệp:
- Sản xuất phân bón: Axit H₂SO₄ được sử dụng để sản xuất phân superphosphate và ammonium sulfate, hai loại phân bón quan trọng trong nông nghiệp.
- Xử lý kim loại: H₂SO₄ được sử dụng trong quá trình tẩy rửa và mạ điện kim loại, giúp làm sạch bề mặt kim loại trước khi sơn hoặc mạ.
- Sản xuất hóa chất: Axit sulfuric là nguyên liệu chính trong sản xuất nhiều hóa chất công nghiệp, bao gồm axit nitric, axit hydrochloric và chất dẻo.
- Sản xuất pin ắc quy: H₂SO₄ được sử dụng trong pin chì-axit (ắc quy axit-chì), loại pin được sử dụng phổ biến trong xe hơi.
- Xử lý nước thải: Axit sulfuric được sử dụng để điều chỉnh độ pH trong hệ thống xử lý nước thải công nghiệp.
4. Tóm tắt quy trình sản xuất axit H₂SO₄ bằng phương pháp tiếp xúc
- Đốt lưu huỳnh: S + O₂ → SO₂.
- Oxy hóa SO₂ thành SO₃: 2SO₂ + O₂ → 2SO₃ (xúc tác V₂O₅).
- Hấp thụ SO₃ vào H₂SO₄: SO₃ + H₂SO₄ → H₂S₂O₇ (oleum).
- Pha loãng oleum: H₂S₂O₇ + H₂O → 2H₂SO₄.
Xem thêm các bài viết liên quan:


