Cơ Khí
Pha loãng axit sunfuric H2SO4 đúng kỹ thuật như thế nào
Axit sunfuric là một loại axit phổ biến trong nền công nghiệp , cũng như sử dụng nhiều trong thí nghiệm tại nhà trường, nhưng axit này cũng là một loại axit có tác hại đến sức khỏe con người , vì thế muốn sử dụng axit sunfuric thì phải biết được cách sử dụng cũng như cách pha loãng axit sunfuric H2SO4 một cách đúng kỹ thuật, thì sẽ đảm bảo an toàn cho bản thân bạn và người xung quanh.
Kỹ thuật pha loãng axit sunfuric H2SO4
Khi bạn đi học cũng như đi làm, axit sunfuric đậm đặt luôn được quản lý cực kỳ chặc chẽ, nếu lỡ để axit sunfuric đậm đặt vào da con người sẽ gây ra hậu quả cực kỳ đau đớn . Vì vậy trên tem nhãn của axit sunfuric H2SO4 luôn có
Xem thêm : Mạ kẽm là gì và quy trình mạ kẽm
+ Hướng dẫn pha loãng ( Hướng dẫn sử dụng )
Không được đổ NƯỚC H20 VÀO AXIT SUNFURIC H2SO4
Điều này cực kỳ quan trọng, nếu bạn đổ nước vào Axit sunfuric sẽ gây ra hậu quả cực kỳ nghiêm trọng, axit sẽ sôi và bắn vào bạn
Vì sao lại như vậy : Vì khi bạn độ nước vào axit sunfuric , Lượng axit trong bồn lớn, lượng nước ít sẽ dẫn đến axit bị sôi và bắn tung tóe, Nếu bạn áp dụng đúng kỹ thuật đổ axit vào nước thì lượng nước nhiều sẽ làm axit sunfuric chìm xuống đáy và sôi bên dưới, ko bị bắn tung tóe
Rồi chúng ta tiếp tục phải giải bài toán ” Bao nhiêu lít nước thì sẽ pha loãng được bao nhiu lít axit , bao nhiu độ “
Hỏi: Có 200ml dung dịch axit H2SO4 đậm đặt 98% (D=1.84g/ml) muốn pha loãng H2SO4 trên thành H2SO4 40% thì cần bao nhiêu lít nước H2O ?
Cách tính số lít nước cần để pha chế
Phương pháp đường chéo
mH2SO4 = 200×1.84 = 368g

Vậy đọc đến đây bạn cũng đã biết bao nhiu lít nước sẽ pha chế được bao nhiu lít axit rồi phải không, tiếp theo mình sẽ hướng dẫn bạn thao tác đúng kỹ thuật để pha chế axit sunfuric
Để pha chế 200ml H2SO4 đậm đặt 98% => Axit sunfuric H2SO4 40% thì cần 533,6ml
Bước 1 : Cho 533,6 ml nước tinh khiết vào bồn
Bước 2 : Cho 200ml axit vào 1 cốc khác, cốc mà ta có thể dễ dàng cầm nó và đổ từ từ
Bước 3 : Cho cốc axit 200ml vào bồn nước một cách từ từ chậm rải nhất có thể để không bắn tung tóe
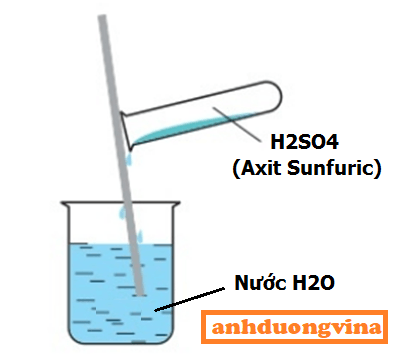
- Cần một chiếc đũa thủy tinh để thực hiện quá trình. Đặt chiếc đũa thủy tinh đứng thẳng, rót từ từ axit sunfuric dọc theo thân đũa cho tới khi hết rồi khuấy nhẹ
- Nên thực hiện quá trình này trong phòng thí nghiệm – nơi có đầy đủ các dụng cụ cần thiết để đảm bảo an toàn. Nếu không bạn có thể thay thế bằng những vật dụng tương tự.
Như vậy bạn đã hoàn tất quá trình pha loãng nhưng bạn còn có những vấn đề cần phải lưu ý
Những lưu ý cần biết khi pha loãng axit sunfuric
+ Không được sử dụng bình thủy tinh để pha loãng axit, chúng ta nên dùng bình nhựa để pha loãng nhé , vì bình thủy tinh có thể vỡ trong quá trình pha loãng, gây ảnh hưởng nghiêm trọng đến người pha chế
+ Không được để Axit Sunfuric tiếp xúc trực tiếp với da và mắt, vì nhiệt lượng tỏa ra rất cao 20kcal sẽ gây cho da bị phỏng, nếu vào mắt thì xem như chúng ta mất đi giác quan .
+ Khi pha loãng axit cần mang các bảo hộ lao động như găng tay chống axit, tạp dề, mặt nạ phòng độc, để bảo vệ cá nhân chúng ta khỏi tác nhân nguy hại từ axit sunfuric
Ứng dụng của axit sunfuric ?
- Axit sunfuric được ứng dụng rộng rãi trong nhiều lĩnh vực từ sản xuất giấy, tơ sợi, phẩm nhuộm, phân bón, chất tẩy rửa, ngành sơn, luyện kim,…
- Nó được biết đến là một hóa chất thương mại. Có tới 60% sản lượng axit sunfuric trên thế giới được ứng dụng trong sản xuất axit photphoric (H3PO4) – một chất sử dụng để sản xuất các loại phân phopahte, amoni photphate,..
- Ứng dụng trong sản xuất kim loại để làm sạch bề mặt thép và tẩy gỉ
- Dùng trong sản xuất nhôm sunfat hay các loại muối sunfat, sản xuất nylon, dược phẩm cùng thuốc trừ sâu,…
- Cùng với nước làm chất điện giải trong hàng loạt các dạng ắc quy hay axit chì,…
- Trong làm sạch: là thành phần chính của một số chất tẩy rửa làm sạch cống rãnh hay các khu vực ô nhiễm
- Trong phòng thí nghiệm: giúp đều chế một số loại axit yếu hơn như HNO3, HCl.
Điều chế axit sunfuric
Trong công nghiệp, axit sunfuric được sản xuất từ lưu huỳnh, nước cùng oxi bằng phương pháp tiếp xúc. Ngoài ra, còn có thể điều chế từ quặng pirit sắt
- Đốt quặng pirit sắt hoặc lưu huỳnh tạo ra khí SO2
S + O2 → SO2
FeS2 + 11O2 → 2FeO3 + 8SO2
- Oxy hóa SO2 bằng oxy có sự xúc tác của V2O5 trong nhiệt độ 400 – 500 oC tạo ra lưu huỳnh trioxit
2SO2 + O2 → 8SO3
- Hòa tan SO3 bằng nước thu được H2SO4
SO3 + H2O → H2SO4
- Ngoài ra, SO3 cũng bị hấp thụ bởi H2SO4 tạo ra oleum với công thức H2SO4.xSO3
H2SO4 + xSO3 → H2SO4.xSO3
- Cho oleum phản ứng với nước tạo thành H2SO4 đậm đặc
H2SO4.xSO3 + xH2O → (x+1)H2SO4
Tính chất hóa học
Là một axit mạnh mang đầy đủ các tính chất hóa học chung của axit
- Đổi màu quỳ tím: làm quỳ tím hóa đỏ
- Tác dụng với kim loại đứng trước H (trừ Pb) cho ra muối sunfat
Fe + H2SO4 → FeSO4 + H2
- Phản ứng với muối tạo ra muối mới và axit mới
Na2CO3 + H2SO4 → NaSO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
- Tác dụng với oxit bazơ
FeO + H2SO4 → FeSO4 + H2O
- Tác dụng với bazơ
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + H2O
Có tính axit và oxi hóa mạnh
- Tác dụng với kim loại
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Tác dụng với phi kim
C + 2H2SO4 →CO2 + 2H2O + 2SO2
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
- Tác dụng với các chất khử khác
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- Tính háo nước
C12H22O11 + H2SO4 →12C + H2SO4.11H2O
Tính chất vật lý
- Là chất lỏng, hơi nhớt, khó bay hơi, nặng hơn nước và tan vô hạn trong nước
- Khi tác dụng với nước tỏa nhiệt nhiều
- Có thể làm than hóa các hợp chất hữu cơ


